导读 当本·奥兰多 (Ben Orlando) 在密歇根州立大学生物化学和分子生物学系发表 2019 年研究演讲时,它为数十年来的合作突破奠定了基础。当
当本·奥兰多 (Ben Orlando) 在密歇根州立大学生物化学和分子生物学系发表 2019 年研究演讲时,它为数十年来的合作突破奠定了基础。
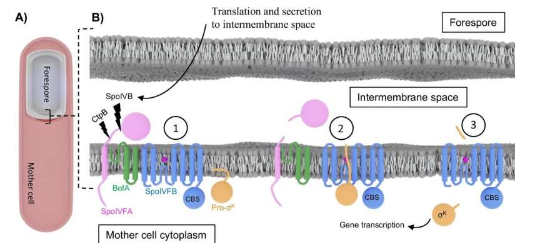
当天在演讲厅的嘉宾是名誉教授李·克罗斯 (Lee Kroos),他刚刚在今年 9 月从密歇根州立大学退休,结束了 30 多年的开创性职业生涯。克罗斯是细菌分子和遗传机制方面的专家,他长期与斯巴达同事合作,试图捕捉一种名为 SpoIVFB 的蛋白质的神秘结构。
SpoIVFB 存在于模型细菌枯草芽孢杆菌中,属于一种称为膜内蛋白酶的特殊酶家族。这些酶有助于调节所有生命界的关键细胞功能。值得注意的是,SpoIVFB 在孢子形成过程中起着关键作用——这一过程使细菌能够在辐射、高温甚至太空真空等恶劣条件下生存。
多年来,捕捉 SpoIVFB 结构的尝试面临着独特的挑战,Kroos 很有兴趣了解奥兰多在尖端低温电子显微镜 (cryo-EM) 领域的专业知识。
“我认为本和我是志同道合的,”克罗斯说,当奥兰多于 2020 年夏天加入生物化学和分子生物学系(BMB)时,克罗斯主动联系了奥兰多,希望能够合作解决 SpoIVFB 的结构难题。“本非常乐观,我们能够在这件事上取得进展。”
现在,奥兰多和克罗斯研究小组在《自然通讯》上发表的一篇论文中报告了首个通过实验确定的高分辨率 SpoIVFB 结构。
具体来说,研究人员发现 SpoIVFB 与其底物结合。就像钥匙开锁一样,底物是酶与之相互作用的特定分子,有助于产生有用的生化产品。
这项研究深入了解了从细菌到人类等生物体中发现的细胞调控机制,对微生物学、结构生物学、酶学和人类疾病具有令人兴奋的意义。
 跳动城乡网
跳动城乡网