研究人员揭示与生物组织再生相关的新分子机制
《EMBO杂志》上发表的一项新研究开辟了新的视角,以更好地理解再生医学所涉及的分子机制如何发挥作用。
该研究的重点是肿瘤坏因子-α (TNF-α) 及其受体 TNFR,这些分子在生物医学中具有重要意义,因为它们与多种疾病有关,例如与 2 型糖尿病相关的肥胖症、炎症性肠病和几种癌症。
这项研究由巴塞罗那大学生物学院和生物医学研究所 (IBUB) 的 Florenci Serras 教授领导。该项研究还涉及 UB 生物多样性研究所 (IRBIO)、基因组调控中心 (CRG) 和 August Pi i Sunyer 生物医学研究所 (IDIBAPS) 的专家。
Ditte S. Andersen 和 Julien Colombani在该期刊的“新闻与观点”栏目中发表的一篇文章也重点介绍了这项工作。
研究结果表明,肿瘤坏因子-α(TNF-α)——一种细胞活性调节蛋白——具有两种 TNFR 受体,它们在响应生物组织损伤时可以表现出完全相反的功能:具体来说,一种受体增强细胞存活和再生,而另一种受体可以促进细胞亡。
该研究采用果蝇研究模型进行,可能有助于设计 TNFR 受体激动剂和拮抗剂分子,以刺激严重烧伤或受炎症性肠病和某些癌症影响的患者的上皮组织再生。
果蝇:研究人类疾病的模型
细胞间通讯是生物体发育和生理学中一个决定性的过程。细胞通讯的途径之一是分泌在生物细胞、组织和器官中具有特定功能的分子,例如肿瘤坏因子 (TNF-α)。
“具体来说,分泌的肿瘤坏因子可以识别并结合位于邻近细胞膜上的受体 TNFR。结合的结果是,TNFR 受体被激活并调节细胞增殖、细胞亡和适应性免疫等多种过程,”布法罗大学遗传学、微生物学和统计学系成员 Serras 解释道。
在哺乳动物基因组中,有 19 个 TNF 分子和 29 个 TNFR 受体,这表明在人类物种中研究它们非常复杂。然而,一些生物体,如果蝇,只有一个肿瘤坏因子(称为 Eiger,Egr)和两个 TNFR,即 Grindelwald(Grnd)和 Wengen(Wgn)受体。
研究人员说:“由于这种简单性,并添加了果蝇的多种遗传工具,我们能够利用这种模型生物来研究 TNF-α/TNFR 的调控和功能。”
具有相反功能的受体
尽管TNF-α和TNFR受体与急性和慢性疾病有关,但“人们对这些成分如何调节细胞亡或细胞存活,甚至细胞增殖等相反的细胞过程仍不太了解”,Serras强调道。
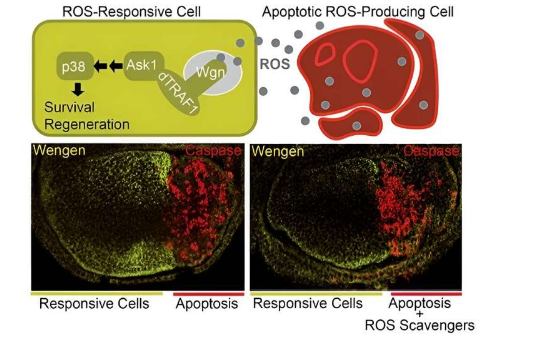
这项研究将纳入博士生 José Esteban-Collado 的博士论文答辩,它提供了支持 TNFR Grnd 和 Wgn 不同且相反的功能的证据。“一方面,Grnd 受体以 TNF-α Egr 依赖的方式通过 TRAF2-dT1-JNK 信号通路促进细胞亡(凋亡),以消除受损细胞,”Serras 说。
“相反,Wgn 受体通过 TRAF1-Ask1-p38 信号通路促进细胞存活和再生,使组织保持健康和良好状态,而不需要 TNF-α Egr,”他补充道。
“也就是说,第一个受体需要配体与受体结合,而第二个受体无需与配体相互作用即可被激活。因此,每个 TNFR 都会促进其信号传导以实现不同的功能,”Serras 解释道。“因此,TNFR 的通讯机制必须在不同 TNFR 的活动、它们启动的分子信号以及它们对配体(TNF-α)的依赖性(或不依赖性)之间产生平衡。”
受损细胞向健康细胞发出分子信号
当细胞亡或受损时,它会与健康细胞沟通,用新细胞取代无功能的细胞,并启动受损组织的再生。这项研究描述了濒细胞如何释放活性氧 (ROS),环境中的功能细胞会吸收这些活性氧,从而驱动受损组织的再生过程。
“在病理情况或组织损伤中,两种受体表现出不同的反应。首先,受影响的组织产生 TNF-α Egr,它与膜上的 Grnd 结合。它被内化并通过细胞亡(凋亡)促进自杀。同时,这些细胞产生 ROS,它扩散并到达健康细胞,作为表明组织恶化的报信号,”Serras 解释说。
Serras 指出:“ROS 信号直接激活健康细胞中的 Wgn,无需 Egr,从而触发促进组织存活、保护和再生的信号通路。”
新研究的结果支持了这样的模型:受损组织中的 ROS 可以激活健康周围细胞中 Wgn 依赖性信号以促进其再生。
作者利用一种优雅的二进制系统,允许在组织特异性域中操纵基因,还确定了 TNFR Wgn(而不是 Grnd)在激活 p38 激酶中的重要作用。“在健康细胞中,这个 p38 将负责启动整个组织修复遗传机制,”Serras 总结道。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
