RNA 干扰 (RNAi) 是许多生物体(包括人类)用来降低细胞中目标 RNA 活性的过程,方法是触发 RNA 降解或将其切成两半。如果目标是信使 RNA(基因和蛋白质之间的中介),那么 RNAi 可以降低或完全抑制基因的表达。

研究人员已经弄清楚了如何定制 RNAi 以对不同的 RNA,从那时起它就被用作沉默目标基因的研究工具。RNAi 还用于越来越多的疗法中,以沉默导致疾病的基因。
然而,研究人员仍然不了解 RNAi 背后的一些生物化学原理。RNAi 机制设计上的细微差异可能会导致其降低基因表达效果的巨大差异。
通过反复试验,研究人员制定出了制作最有效的 RNAi 工具的指导方,但并不完全了解它们的作用原理。
然而,怀特黑德研究所成员 David Bartel 和他实验室的研究生 Peter Wang 现在已经深入研究了 RNAi 中涉及的主要细胞机器的机制。研究人员的发现于 7 月 17 日在《分子细胞》杂志上发表,不仅为一些已知的 RNAi 工具设计规则提供了解释,而且还提供了可以改进未来设计的新见解。
切片速度变化很大
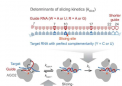
执行 RNAi 的细胞机器有两个主要部分。一个是向导 RNA,这是一种微小的 RNA,通常只有 22 个碱基或核苷酸长。RNA 与 DNA 一样,由四种可能的碱基组成,尽管 RNA 的碱基是尿嘧啶 (U),而不是 DNA 碱基胸腺嘧啶 (T)。
RNA 碱基以某种方式相互结合 - 鸟嘌呤 (G) 与胞嘧啶 (C) 配对,腺嘌呤 (A) 与 U 配对 - 并且向导 RNA 中的碱基序列与目标 RNA 内的互补序列相对应。
当向导 RNA 遇到目标时,相应的碱基会配对,将 RNA 结合。然后 RNAi 机器的另一部分,即与向导 RNA 结合的 Argonaute 蛋白,可以将目标 RNA 切成两半或触发细胞更缓慢地分解它。
在人类中,AGO2 是 Argonaute 蛋白中切片能力最强的。实际上,只有几十个 RNA 靶标会被切片,但这几个靶标在神经元信号控制和精确的身体形状形成等过程中发挥着至关重要的作用。切片对于 RNAi 工具和疗法也很重要。
为了使 AGO2 切割其靶标,靶标必须处于正确的位置。当向导 RNA 和靶标 RNA 结合在一起时,它们会经历一系列运动,最终形成双螺旋。只有在这种配置下,AGO2 才能切割靶标。
研究人员曾假设 AGO2 切割不同靶 RNA 的速度大致相同,因为大多数研究都使用相同的几种向导 RNA。这些向导 RNA 恰好具有相似的特征,因此切割动力学也相似——但事实证明它们并不代表大多数向导 RNA。
王将 AGO2 与种类更多的向导 RNA 配对,并测量了每个 AGO2-向导 RNA 复合物切割目标的速度。他发现有很大的差异。虽然常用的向导 RNA 的切割速度可能相差 2 倍,但更大的向导 RNA 池相差多达 250 倍。
切片速度通常比研究人员预期的要慢得多。此前,研究人员认为所有目标都可以相对较快地切片,因此切片速度不被视为限制因素——人们认为该过程的其他部分决定了整体速度——但王发现,切片有时可能是最慢的步骤。
“重要的考虑因素是切片速度是否比细胞中的其他过程更快或更慢,”王说。“我们发现,对于许多向导RNA来说,切片速度是限制因素。因此,它影响了功效。”
AGO2 切割靶标的速度越慢,保留下来并被制成蛋白质的信使 RNA 就越多,这意味着相应的基因将继续表达。研究人员观察到了这一点:切割速度较慢的向导 RNA 降低靶标基因表达的速度比切割速度较快的向导 RNA 低。
微小的变化会导致切片率的巨大差异
接下来,研究人员探索了导致向导 RNA 之间的切割率差异如此之大的原因。他们突变向导 RNA,以交换向导 RNA 序列上的单个碱基(例如,将序列中的第 10 个碱基从 C 切换到 A),并测量这如何改变切割率。
研究人员发现,当位置 7 上的碱基为 A 或 U 时,切片率会增加。碱基 A 和 U 的配对比 C 和 G 的配对更弱。研究人员发现,在该位置上存在较弱的 AU 对,或者位置 6 或 7 上存在完全不匹配的 AU 对,可能会导致双螺旋形状形成扭结,这实际上使目标更容易切片。
王还发现,在第 10 和第 17 个碱基位置进行某些替换时,切割率会增加,尽管研究人员尚未确定可能的潜在机制。
这些观察结果与现有的 RNAi 设计建议相符,例如不要在位置 7 使用 G。新研究表明,这些建议之所以有效,是因为它们会影响切片率,并且就位置 7 而言,新研究进一步确定了起作用的具体机制。
区域间相互作用至关重要
设计合成向导RNA的人认为尾端16位以后的碱基不是很重要。这是因为在最常用的向导RNA中,即使所有尾端位置都是无法配对的错配,靶标也会被快速切割。
然而,Wang 和 Bartel 发现,尾端碱基的身份仅在特定情况下才无关紧要,而这种情况恰好适用于最常用的向导 RNA:当向导 RNA 中心(位置 9-12)的碱基是强配对的 C 和 G 时。
当中心配对较弱时,尾端碱基需要与目标 RNA 完美匹配。研究人员发现,根据中心配对的强度,向导 RNA 对尾端错配的容忍度可能相差高达 600 倍。
这种差异的原因与两种 RNA 必须执行的最终运动有关,以便形成最终的双螺旋形状。完美配对的尾端使 RNA 更容易完成这些运动。然而,即使尾端不太适合这样做,足够强大的中心也可以将 RNA 拉入双螺旋。
弱中心配对需要完美或近乎完美的尾端匹配,这一观察结果可以为设计合成 RNA 提供有用的新指导。任何向导 RNA 都有可能与与预期靶 RNA 足够相似的其他信使 RNA 结合。在治疗中,这种脱靶结合可能导致负面副作用。
Bartel 和 Wang 建议研究人员可以设计具有弱中心的引导 RNA,这样就需要尾端更完美的配对,这样引导 RNA 就不太可能结合非目标 RNA;只有完美配对目标 RNA 序列才足够。
总而言之,Wang 和 Bartel 的研究结果解释了向导 RNA 之间的微小差异如何导致 RNAi 效果的巨大差异,为长期存在的 RNAi 设计指南提供了理论依据。一些研究结果甚至提出了可能有助于未来合成向导 RNA 设计的新指南。
“发现引导 RNA 中心和尾端之间的相互作用是出乎意料且令人满意的,”说,他也是麻省理工学院的教授和霍华德休斯医学研究员。
“这解释了为什么尽管指南表明尾端序列并不重要,但在我们的细胞中切片的靶 RNA 确实与尾端配对。这一观察结果可能有助于减少 RNAi 疗法中的脱靶效应。”
 跳动城乡网
跳动城乡网