将线粒体从患者健康的骨骼肌转移到受损的缺血心脏组织已被证明可以恢复心肌,增加能量产生,并改善心室功能。
大约十年前,波士顿儿童医院的 James McCully 博士进行了开创性的临床前工作,此后,由医学博士 Sitaram Emani 领导的心脏外科医生一直在测试这种方法,以帮助患有先天性心脏病和缺血再灌注损伤的儿童摆脱 ECMO 的依赖。
“我们意识到,如果添加线粒体,康复的概率会高得多,”埃玛尼说。迄今为止,已有 16 名儿童接受了自体线粒体移植。其中,80% 的人能够摆脱 ECMO,而历史上这一比例仅为 40%。
但线粒体转移一直受到质疑——部分原因是没有人真正知道它为什么起作用。
“我们假设是线粒体进入细胞,接管并产生细胞的所有能量,”埃玛尼说。“但奇怪的是,我们只需要非常少量的线粒体就能让心肌恢复。这根本说不通。”
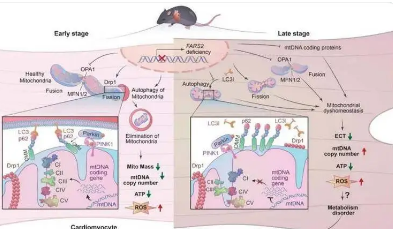
心脏外科系研究员 Juan Melero-Martin 博士领导的一项研究在《自然》杂志上发表,发现了一个令人惊讶的解释。转移的线粒体会通过自噬(一种细胞内务管理)触发细胞破坏其低性能的线粒体。
这为细胞提供了更好的线粒体库,改善了细胞的生物能和健康状况。这一发现最终可以改善对各种心脏病的治疗。
追踪线粒体的活动
Melero-Martin 实验室的初衷是不同的,但长期目标是:培育血管网络,为人造组织提供供给,使组织移植更有效。这种血管网络还可以输送药物或基因疗法,或为移植细胞(如糖尿病患者的胰岛素生成细胞)提供家园。
为了构建网络,实验室研究了构成血管的内皮细胞。但还需要额外的推动力。“我们意识到内皮细胞需要间充质细胞等支持细胞来帮助它们植入体内组织,”Melero-Martin 说。
研究小组随后发现,内皮细胞的植入依赖于伴随的间充质细胞中线粒体的转移。当他们分离出线粒体并将其直接与内皮细胞一起孵育时,细胞变得更适合,植入能力也更强。
“但我们的实验都没有触及细胞到底发生了什么以及它们如何从线粒体中获益,”梅勒罗-马丁说。
因此,研究人员决定给线粒体贴上标签,并在将其放入细胞后对其进行追踪。“几天后,它们就不见踪影了;它们正在退化,”梅勒罗-马丁说。“但我们仍然看到细胞中的能量有所增加。我们感到很困惑。”
最新研究表明,线粒体的涌入会触发一个开关,使细胞“清理房屋”,消化旧的线粒体并产生新的供应。但对于临床应用而言,线粒体的转移似乎很难使细胞恢复活力。无需实际移植线粒体,就能触发自噬吗?
Melero-Martin 的实验室正在研究各种可能性。其中包括设计可用于任何患者的现成线粒体、仅使用部分线粒体,或直接触发与自噬有关的分子通路。(这项研究确定了其中一种通路,PINK1-Parkin。)
将线粒体应用于心脏移植
与此同时,Emani 正在研究线粒体移植能否提高循环亡 (DCD) 后捐献心脏的心脏移植成功率。DCD 心脏可能会扩大捐献者库,但存在缺血性损伤,因此很难移植。
“我们知道患者在移植后会出现一段时间的缺血再灌注损伤,”Emani 说道。“我们认为用线粒体治疗将有助于他们的康复。”
McCully 和 Emani 之前曾证明,线粒体移植可以在 DCD 移植动物模型中保留心肌功能。现在,通过与新英格兰捐献服务中心的合作,他们正在研究未用于移植的人类 DCD 心脏。
该临床前方案包括恢复心脏活力、输送线粒体或安慰剂以及测量心脏功能。
“如果成功,这将真正扩大捐献物的利用能力,”埃玛尼说。“下一步将是临床试验。”
Emani 还着眼于利用线粒体治疗左心发育不全综合征 (HLHS)。他和同事刚刚完成了一项小型随机试验,研究将用线粒体预处理的间充质祖细胞转移到左心室心内膜,以帮助 HLHS 患者实现双心室循环。
他认为线粒体可以改善间充质细胞的植入,他希望这反过来可以增强心室功能并刺激心肌重塑。
“我们一直在考虑用细胞疗法治疗心脏病,并通过提供血管供应来优化移植物,如新的心脏瓣叶或心脏贴片,”Emani 说。“Juan 的研究结果为我们理解移植的线粒体如何工作提供了一个缺失的环节。”
 跳动城乡网
跳动城乡网