6月6日, 《自然微生物学》杂志发表一项研究,中国科学院上海有机化学研究所徐代超教授团队领导的科研团队发现了葡萄糖感应与非经典细胞焦亡之间的分子联系。
营养状态和细胞焦亡在宿主防御病原体中起着关键作用。越来越多的证据表明,宿主细胞营养状态的变化,特别是葡萄糖水平的变化,对其应对病原体感染至关重要。
在细菌感染过程中,宿主细胞的葡萄糖水平可能会发生波动。这种波动可能是宿主免疫防御的一部分,因此是有益的,也可能是感染不可避免的不良后果。
细胞焦亡是一种受调控的细胞亡形式,可诱导宿主细胞的炎症反应并有助于宿主细胞的免疫防御。然而,微生物感染期间宿主细胞营养状况与细胞焦亡之间的分子关联仍不清楚。
AMPK 是一种细胞内丝氨酸/苏氨酸激酶,是一种对代谢压力作出反应的中枢能量传感器。它不仅可以通过感知细胞内能量状态的下降而被激活,还可以通过感知葡萄糖水平而被激活。
在微生物感染过程中,宿主细胞需要大量的能量来驱动免疫反应,因此大多数胞内病原体感染都与宿主AMPK的激活有关。
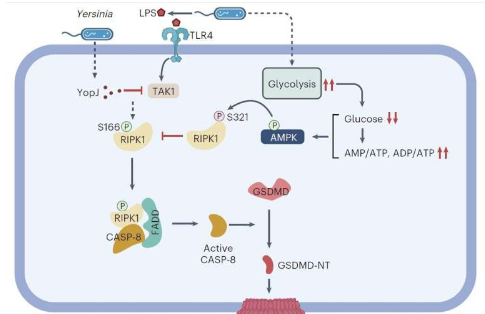
在这项研究中,研究人员发现,在耶尔森氏菌感染的早期阶段,耶尔森氏菌能够诱导宿主免疫细胞内糖酵解水平急剧增加,导致免疫细胞内葡萄糖水平和小鼠血糖水平迅速显著下降,最终导致宿主AMPK过度激活。
正常情况下,耶尔森菌感染宿主细胞后,宿主细胞会激活RIPK1-caspase-8-GSDMD介导的非经典细胞焦亡通路,以抑制其增殖。然而,宿主细胞中激活的AMPK可以通过在高度保守的S321位点进行抑制性磷酸化,直接抑制RIPK1,从而限制其激酶活性和随后的caspase-8活化,阻止细胞焦亡,并促进对感染的不利反应。
研究人员发现,过度激活小鼠体内的 AMPK(无论是使用 AMPK 激动剂,还是在耶尔森菌感染期间使用葡萄糖耗竭等方法)都会加重感染的严重程度。相反,敲除巨噬细胞中的 AMPK 或补充葡萄糖以抑制小鼠耶尔森菌感染期间的 AMPK 活性,可以显著提高小鼠对耶尔森菌感染的抵抗力。
总之,本研究调查了耶尔森氏菌感染期间葡萄糖稳态改变对 AMPK 活化调节和 RIPK1 依赖性细胞焦亡的影响。
此外,还阐明了病原体感染对宿主细胞营养状态改变的调节作用及其对宿主细胞免疫防御的影响。本研究结果表明,维持患者的营养状态和血糖水平可能是治疗耶尔森氏菌感染的关键。
 跳动城乡网
跳动城乡网